- Registriert
- 19 Sep. 2007
- Beiträge
- 1.363
Hallo ihr Chemiker das draußen
Ich würde gerne wissen, wie man aus der Summenformel eines Stoffes seinen Brennwert berechnet.
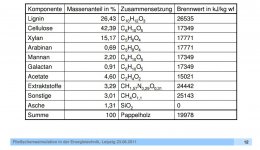
Gegeben sei C10H14O7 als Summenformel für Holz.
Wie kann ich chemisch bzw. rechnerisch nachweisen, das der Brennwert bei ca. 5 kWh/mg Holz liegt?
Grüße Kolja
Ich würde gerne wissen, wie man aus der Summenformel eines Stoffes seinen Brennwert berechnet.
Gegeben sei C10H14O7 als Summenformel für Holz.
Wie kann ich chemisch bzw. rechnerisch nachweisen, das der Brennwert bei ca. 5 kWh/mg Holz liegt?
Grüße Kolja